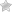Лечение
Первый шаг к лечению – ликвидация негативных воздействий неблагоприятных факторов, усиливающих кровоточивость. Например, алкоголь и отдельные блюда (домашние заготовки с уксусом и салицилатами) попадают под строжайший запрет. Зато витамины (А, Р, С), наоборот, занимают достойное место в рационе. Кроме этого, их назначают (преимущественно в зимне-весенний период, когда собственные запасы истощаются) в виде медикаментозных форм.
Придется пациенту забыть и о препаратах, нарушающих функции тромбоцитов и способствующих усилению кровоточивости (НПВП, аминазин, фибринолитики, антикоагулянты, антибиотики пенициллинового ряда и др.). Прямой антикоагулянт гепарин используется исключительно по жизненным показаниям (в случае развития ДВС-синдрома).
Для лечения сопровождающихся значительной кровоточивостью наследственных видов тромбоцитопатий у детей и взрослых (эссенциальная атромбия, дезагрегационная тромбоцитопатия, болезнь Виллебранда легкой и среднетяжелой формы) назначают аминокапроновую кислоту в дозе, рассчитанной в соответствии с весом. Особенно выражен положительный эффект от препарата при кровотечениях из матки и носовых ходов.
Полезной оказывается аминокапроновая кислота и в случае приобретенной патологии первичного гемостаза (тромбоцитопатии, возникшие после массивных гемотрансфузий, приема лекарственных средств, маточных кровотечений, вызванных снижением эстрогенов).
Аминокапроновую кислоту назначают внутривенно, однако следует учитывать, что введение ее в вену может спровоцировать тромбозы или ДВС-синдром, поэтому препарат используют осторожно и только в экстренных случаях, когда кровотечение угрожает жизни больного. Для лечения нарушений тромбоцитарно-сосудистого гемостаза различного генеза, помимо аминокапроновой кислоты, нередко применяются ее «родственники» – транексамовая кислота, которая имеет таблетированные формы (циклокапрон) и парааминометилбензойная кислота (ПАМБА)
Для лечения нарушений тромбоцитарно-сосудистого гемостаза различного генеза, помимо аминокапроновой кислоты, нередко применяются ее «родственники» – транексамовая кислота, которая имеет таблетированные формы (циклокапрон) и парааминометилбензойная кислота (ПАМБА).
Напоминают тромбоцитам об их непосредственных задачах (склеиваться и образовывать конгломераты) и противозачаточные средства (синтетические гормональные контрацептивы), они помогают заметно снизить кровоточивость при симптоматических (приобретенных) формах. Однако, как говорят, существует и обратная сторона медали. Положительному кровоостанавливающему эффекту оральных контрацептивов противостоит риск тромбозов и провокация ДВС-синдрома. Также может оказаться опасным для жизни одновременное применение противозачаточных средств и аминокапроновой кислоты. Здесь без профилактики ДВС вряд ли получится обойтись.
Другие препараты, назначаемые при различных видах тромбоцитопатий:
- АТФ (аденозинтрифосфат) совместно с сернокислой магнезией (MgSO4). Подобная терапия дает эффект при парциальной дезагрегационной тромбоцитопатии, протекающей с нарушением «реакции освобождения, и практически бесполезна в случае эссенциальной атромбии, тромбастении Глянцмана, синдроме Хержманского-Пудлака и синдроме «серых тромбоцитов»;
- Адроксон – повышает функциональные способности кровяных пластинок, содействует нормализации микроциркуляторного гемостаза, препарат назначают при любых видах патологии, в том числе, сочетающихся с ДВС-синдромом;
- Дицинон (внутримышечно, подкожно, перорально);
- Антагонисты брадикинина (ангинин, пармидин);
- Синтетические производные вазопрессина (реместил, терлипрессин), которые вызывают рост активности фактора Виллебранда и сочетаются с другими гемостатическими средствами (аминокапроновая кислота, криопреципитат);
- Антигемофильная плазма и криопреципитат (используется при болезни Виллебранда, как главное заместительное лечение, а также при тромбастении Глянцмана, эссенциальной атромбии, приобретенных тромбоцитопатиях).
Следует отметить, что гемотрансфузии в большинстве случаев гемостатического эффекта не дают и пользы не приносят, а переливания больших объемов крови еще и усложняют ситуацию, поскольку приводят к развитию ДВС с тромбоцитопенией потребления. Правда, при массивных кровопотерях все же трудно избежать переливаний плазмы свежезамороженной, тромбоконцентрата, эритроцитарной массы.
Причины и лабораторные признаки
К сожалению, до сих пор причины возникновения этой аномалии не установлены, но зато известен механизм наследственной передачи, это аутосомно-доминантный тип. Он в одинаковой степени может проявляться и у гомозиготных, и у гетерозиготных пробандов. В основе ее развития лежит особое изменение лейкоцитарных ядер.
Известно, что обычные, зрелые нейтрофилы имеют сегментированное ядро, в то время как пельгеризация ядер нейтрофилов возникает по причине нарушения процессов сегментации. В итоге ядра сохраняют юную форму при наступлении полноценной зрелости.
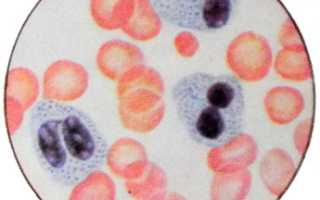
Если у нормальных нейтрофилов ядра разделяются на несколько долек, обычно четыре или пять, то при аномалии Пельгера, если посмотреть в микроскоп, то зрелые, и вполне полноценные нейтрофилы имеют ядро, у которого только две дольки, редко три. Посередине у этой долек перетяжка, поэтому такое ядро напоминает или плод арахиса, или гимнастическую гантель или пенсне. В любом случае, сколько бы сегментов не содержало ядро пельгеровского лейкоцита, у него существует ещё одна особенность. Это ядро имеет комковатую структуру, а перемычки между долями довольно короткие.
Такие аномальные нейтрофилы очень похожи на юные лейкоциты — миелоциты нормальной структуры, и это может служить ошибкой у врачей-лаборантов, и даже у гематолога. При этом, каковы бы ни были варианты ядерной структуры, пельгеровские нейтрофилы являются абсолютно здоровыми и полноценными клетками. Они также могут выполнять фагоцитоз, поглощение и переваривание вредных микроорганизмов, содержат столько ферментов, сколько нужно, живут столько же, сколько и нормальные лейкоциты, и реагируют на все патологические процессы точно так же.
Аномалия Мея-Хегглина
Аномалия Мея-Хегглина — это редкое наследственное заболевание, характеризующееся появлением в крови аномально больших и бесформенных тромбоцитов, а также гигантских и дефектных лейкоцитов. Дефектные лейкоциты содержат так называемые островки Деле, имеющие размер от 2 до 5 мкм. Расположены они в жидкой среде клетки — цитоплазме. ирода происхождения таких островков инфекционная, при клиническом изучении было отмечено, что островки Деле реагируют на метиленовую синьку, окрашиваясь в голубой цвет, а с оксидазой в реакцию не вступают. Аномальный ген может быть унаследован от обоих родителей, а также может являться результатом новой мутации (изменения генов) у отдельных больных. Риск передачи аномального гена от родителей к потомству составляет 50% для каждой беременности, независимо от пола будущего ребенка.
Симптомы аномалии Мея-Хегглина
Проявления аномалии Мея-Хегглина у некоторых больных могут полностью отсутствовать, а у других проявляются в аномальных кровотечениях. В легких случаях лечение аномалии не требуется. В более тяжелых случаях необходимо переливание тромбоцитов.
Основные симптомы:
- красные или фиолетовые пятна на коже (пурпура);
- кровотечение из носа;
- кровотечение изо рта во время стоматологических процедур;
- головные боли;
- односторонняя слабость мышц (половины тела);
- внутричерепные кровотечения.
Кровотечения могут усиливаться после прекращения приема стероидных препаратов.
Последние исследования аномалии Мея-Хегглина показали, что заболевание входит в группу семейства пяти аутосомно-доминантных расстройств, для которых характерно присутствие в крови гигантских тромбоцитов, каждый из которых содержит различные вариации (аллели) одного и того же гена. Другие нарушения, связанные с появлением гигантских тромбоцитов, это: синдром Себастьяна, синдром Фехтнера, синдром Эпштейна, макротромбоцитопенический синдром.
Медики полагают, что понимание механизмов какого-либо из указанных выше синдромов может помочь лучше изучить этиологию аномалии Мея-Хегглина.
Лечение аномалии Мея-Хегглина
Основной метод лечения, устраняющий опасные симптомы — это переливание тромбоцитов. Легкие проявления аномалии Мея-Хегглина в лечении не нуждаются. Носители дефектного гена должны в обязательном порядке получить консультацию специалиста по генетике.
Аномалия лейкоцитов Пельгера
Впервые была описана голландским гематологом Пельгером в 1830 г. В настоящее время встречается довольно часто. Наследование этой аномалии осуществляется по доминантному типу от одного из родителей (гетерозиготы) или, что встречается редко, от обоих (гомозиготы).
В крови страдающих этой аномалией обнаруживается огромное количество круглоядерных лейкоцитов. Теоретически вероятность гомозиготного варианта пельгеровской аномалии составляет 1:1000000, фактически она встречается еще реже.
Описаны всего четыре случая достоверных гомозиготов. При гетерозиготном наследовании аномалия передается из поколения в поколение и определяется у 50 % членов семьи. Таким образом, наличие у отдельных членов семьи нормальной лейкограммы не противоречит семейно-наследственному характеру аномалии.
Особенностью лейкоцитов при аномалии Пельгера является форма ядра.
Большинство нейтрофильных гранулоцитов имеют однодолевое несегментированное эллипсовидное, бобовидное или почкообразное ядро, более короткое, чем ядро обычного нейтрофильного гранулоцита. В других клетках ядра с намечающейся перетяжкой посредине напоминают по форме гимнастическую гирю или земляной орех (арахис). Бывают также клетки с ядрами, переходными к двусегментарным (имеющим вид пенсне); ядра с тремя сегментами почти не встречаются.
Как дву-, так и трисегментоядерные формы отличаются короткими перемычками и комковатым строением ядра. Нейтрофильные гранулоциты с большим количеством сегментов при аномалии Пельгера не встречаются. Наряду с несегментированными, палочкоядерными и сегментоядерными нейтрофильными гранулоцитами наблюдаются и кругло-ядерные, которые признаны вполне зрелыми клетками. Особенность их развития заключается в полном отсутствии ядерного полиморфизма, т. е. ядро их по структуре хроматина старое, а по форме — юное.
Во избежание ошибочной трактовки анализа при наличии указанных форм нейтрофильных гранулоцитов врач-лаборант обязан дать заключение о том, что описанная картина крови характерна для аномалии лейкоцитов Пельгера.
При наличии подобных изменений формы ядра в эозинофильных и базофильных гранулоцитах эти клетки также подсчитываются дифференцированно (круглоядерные, несегментированные, палочкоядерные, двусегментоядерные и трисегментоядерные).
По физиологическим свойствам лейкоциты при аномалии Пельгера ничем не отличаются от обычных. У женщин — носителей этой аномалии половой хроматин не выявляется. У женщин — частичных носителей аномалии могут наблюдаться нейтрофильные гранулоциты с половым хроматином (последний в виде телец Барра обнаруживается и в ядрах клеток слизистой оболочки полости рта, в которых обычно исследуется половой хроматин). Указанный феномен объясняется задержкой сегментации ядер пельгеровских нейтрофильных гранулоцитов, вследствие чего половой хроматин остается как бы замурованным в массе ядра.
В костном мозге преобладают круглоядерные нейтрофильные гранулоциты (до 65 %). Среди них обнаруживаются зрелые клетки с круглым, овальным или эллипсоидным ядром. Таким же образом происходит развитие характерных для аномалии Пельгера круглоядерных эозинофильных гранулоцитов. Эритрокариоциты составляют не более 15—20 %, причем встречаются почти исключительно нормобласты с пикнотическим ядром при различной степени гемоглобинизации.
Наряду с аномалией лейкоцитов Пельгера, носящей семейно-наследственный характер, в последние годы появились описания приобретенных форм гипосегментации ядер нейтрофильных гранулоцитов — пельгероидов.
Псевдопельгеровские лейкоциты, в отличие от истинных, в крови обнаруживаются непостоянно. Появление их связано с основным заболеванием.
Следует также помнить о возможности наличия у носителей пельгеровской аномалии одновременно и аномалии лейкоцитов Штодмейстера. В отличие от типично пельгеровских круглоядерных нейтрофильных гранулоцитов с грубоглыбчатой фрагментированной структурой ядер, имеющих четкие контуры, ядра при аномалии Штодмейстера характеризуются менее выраженной конденсацией хроматина, наличием бухтообразной выемки и своеобразной бахромчатости, состоящей из нежных хроматиновых нитей, как бы выступающих из основной массы ядра в цитоплазму. Эта аномалия также носит семейный характер и может обнаруживаться не только при пельгеровском варианте, но и самостоятельно.
Токсогенная зернистость нейтрофильных гранулоцитов
Формирование специфической зернистости нейтрофильных гранулоцитов начинается в комплексе Гольджи. Размеры гранул колеблются от 0,2 до 0,5 мкм, форма их округлая или слегка продолговатая.
Округлую, первичную, зернистость содержат незрелые клетки нейтрофильного ряда — промиелоциты; продолговатую, вторичную, специфическую — зрелые нейтрофильные гранулоциты — палочкоядерные и сегменто-ядерные.
В миелоцитах и метамиелоцитах обнаруживаются как первичные, так и вторичные гранулы.
Образование токсогенной зернистости происходит внутри клетки в результате физико-химических изменений белковой структуры цитоплазмы под влиянием продуктов интоксикации. Появление ее объясняется выходом в периферическую кровь незрелых нейтрофильных гранулоцитов костного мозга, содержащих первичные гранулы, богатые белками, обладающими бактерицидными свойствами, а также гликозамингликанами и лизином.
Токсогенная зернистость нейтрофильных гранулоцитов нередко появляется раньше ядерного сдвига. Ее нарастание при гнойно-септических заболеваниях, крупозной пневмонии и ряде воспалительных заболеваний указывает на прогрессирование патологического процесса и возможность неблагоприятного исхода. В большом количестве токсогенная зернистость нейтрофильных гранулоцитов появляется при распаде опухолевой ткани под влиянием лучевой терапии. Наиболее выражена токсогенная зернистость при крупозной пневмонии в период рассасывания воспалительного инфильтрата, при скарлатине, септикопиемии, перитоните, флегмоне и прочих гнойных процессах
Особенно важное значение имеет токсогенная зернистость в диагностике острого живота (например, гангренозного аппендицита, протекающего с незначительно повышенной температурой тела и нередко при отсутствии лейкоцитоза). При описании токсогенной зернистости (мазок крови окрашивается карболфуксинметиленовым синим по Фрейфельд) указывают процент содержащих ее клеток и размеры зернистости (мелкая, среднего размера, крупная, хлопьевидная).
Пельгеровская аномалия лейкоцитов
Пельгеровская аномалия нейтрофилов – это доброкачественная наследственная патология, которая характеризуется морфологическим изменением лейкоцитов. Получила название в честь Карла Пельгера – голландского врача, впервые открывшего в 1928 году нетипичные нейтрофилы.
Затем в 1932 году Хьюэтом была доказана наследственная природа заболевания. Поэтому в некоторых источниках болезнь называется аномалия Пельгера-Хьюэта. Встречается с частотой 1:1000-1500, одинаково часто у мужчин и женщин.
Раньше встречалась редко, а в последнее время все чаще, что связано с более широкими обследованиями крови.
Причины
Причины данного заболевания не установлены. Известно, что аномалия передается по аутосомно-доминантному типу, проявляется и у гетерозигот, и у гомозигот в равной степени. В основе патогенеза лежит нарушение сегментации зрелых нейтрофилов. Генетическая поломка заключается в нарушении структуры регуляторного гена, отвечающего за форму ядра.
Диагностика
Диагностика основана на исследовании мазков крови в гематологических анализаторах. Оценивается зрелость ядра, состояние хроматина (у аномальных он плотный), соотношение нейтрофилов в крови. Чтобы уточнить диагноз, нужно провести анализ крови родителей, у которых будет похожая формула крови.
Следует дифференцировать с хроническим миелолейкозом, при котором возрастает число юных нейтрофилов, а лейкоцитарные формулы обоих заболеваний схожи.
При этом у больного пельгеровской аномалией в крови будет наличие характерных зрелых двусегментированных нейтрофилов, а количество лейкоцитов и остальных форменных элементов нормальное.
Кроме пельгеровской аномалии, являющейся врожденной, имеется приобретенная форма гипосегментации нейтрофилов.
Встречается при остром и хроническом миелолейкозе, микседеме, малярии, гриппе, туберкулезе, эритромиелозе, инфекциях, системной красной волчанке, болезни Ходжкина.
Часто возникает после проведенной химиотерапии и приема некоторых лекартсвенных средств (например, НПВС, сульфаниламидов). Отличается от аномалии тем, что является временным состоянием.
Лечение
Пельгеровская аномалия не требует лечения, так как функции крови сохранены в полном объеме. Ее носители считаются здоровыми людьми.
Важное значение имеет обследование детей на предмет выявления этой аномалии крови, так как соотношение клеточного состава не подвергается значительным изменениям в течение жизни. Обнаружение аномалии помогает избежать неправильной диагностики многих заболеваний, дающих аналогичную картину крови
Аномалии нейтрофилов
Чтобы понять, почему нейтрофилы так ведут себя в тех или иных ситуациях, следует лучше изучить не только характеристики, присущие здоровым клеткам, но и познакомиться с их патологическими состояниями, когда клетка вынуждена переживать необычные для себя условия или неспособна нормально функционировать из-за наследственных, генетически обусловленных дефектов:
- Наличие в ядре более 5 сегментов (гиперсегментация) относится к признакам мегалобластной анемии или указывает на проблемы с почками или печенью;
- Вакуолизацию цитоплазмы считают проявлением дегенеративных изменений на фоне инфекционного процесса (клетки активно заняты в фагоцитозе – сепсис, абсцесс);
- Присутствие телец Деле свидетельствует, что нейтрофилы пережили экстремальные условия (эндогенная интоксикация), в которых им пришлось созревать (грубые гранулы в клетке – токсическая зернистость);
- Появление близких к тельцам Деле зерен Амато чаще указывает на скарлатину (хотя и другие инфекции не исключает);
- Аномалия Пельгера-Хюэта (пельгеровская аномалия, аутосомно-доминантный тип наследования), характеризуется уменьшением сегментов в ядре, а сам нейтрофил напоминает пенсне. Псевдоаномалия Пельгера-Хюэта может наблюдаться на фоне эндогенной интоксикации;
- Пельгеризация нейтрофильных ядер – ранний признак нарушения гранулопоэза, наблюдается при миелопролиферативных заболеваниях, неходжкинской лимфоме, тяжелой инфекции и эндогенной интоксикации.
Приобретенные аномалии и врожденные дефекты нейтрофилов не лучшим образом сказываются на функциональных способностях клеток и на здоровье пациента, в крови которого обнаружены неполноценные лейкоциты. Нарушение хемотаксиса (синдром ленивых лейкоцитов), активности ферментов в самом нейтрофиле, отсутствие реакции со стороны клетки на поданный сигнал (дефект рецепторов) – все эти обстоятельства заметно снижают защитные силы организма. Клетки, которые должны быть первыми в очаге воспаления, сами «болеют», поэтому не знают, что их ждут или не могут выполнить возложенные на них задачи, даже если в таком состоянии прибудут на место «аварии». Вот такие они важные – нейтрофилы.
Что такое пельгеровская аномалия?
Пельгеровская аномалия — это генетическое заболевание, которое влияет на форму и структуру ядер нейтрофилов — типа белых кровяных клеток, ответственных за борьбу с инфекциями. Нейтрофилы с пельгеровской аномалией имеют характерную двуядерность, их ядра выглядят как палочка или груши.
Пельгеровская аномалия является редким наследственным заболеванием. Она может быть унаследована как доминантным, так и рецессивным способом. У людей с пельгеровской аномалией может быть только одно затронутое ядро в нейтрофилах (однодиференцированный фенотип) или оба ядра могут быть затронутыми (двудиференцированный фенотип).
Обычно пельгеровская аномалия не вызывает серьезных проблем со здоровьем и может быть случайным обнаружением при анализе крови. Однако у некоторых людей с этим заболеванием могут быть некоторые симптомы, такие как повышенная усталость, повышенная чувствительность к инфекциям и проблемы со зрением.
Для диагностики пельгеровской аномалии проводятся кровяные тесты, включая микроскопический анализ нейтрофилов. Визуальное определение аномалии исключительно на основе вида ядер нейтрофилов, исходя из ее палка или груши вместо обычных сегментированных ядер, может привести к неверным диагнозам.
Лечение пельгеровской аномалии не требуется, если нет других симптомов или проблем со здоровьем. Однако, если у пациента есть повышенная чувствительность к инфекциям, могут назначаться профилактические антибиотики для предотвращения инфекций
Кроме того, важно оценить другие возможные проблемы со здоровьем, связанные с пельгеровской аномалией, такие как проблемы со зрением или обнаружение других генетических нарушений.
В заключение, пельгеровская аномалия — это генетическое заболевание, которое влияет на форму и структуру ядер нейтрофилов. Оно может быть унаследовано и, хотя обычно не вызывает серьезных проблем со здоровьем, требует медицинского наблюдения и оценки возможных проблем.
Всегда и всюду первые
Причины повышения нейтрофилов не всегда связаны с какой-то патологией. Ввиду того, что данные представители лейкоцитов всегда стремятся быть первыми, то они будут реагировать на любые изменения в организме:
- Сытный обед;
- Интенсивный труд;
- Положительные и отрицательные эмоции, стресс;
- Предменструальный период;
- Ожидание ребенка (при беременности, во второй половине);
- Период родоразрешения.
Такие ситуации, как правило, остаются незамеченными, нейтрофилы повышены незначительно, а анализ в такой момент мы не бежим сдавать.
Другое дело, когда человек чувствует, что заболел и лейкоциты нужны в качестве диагностического критерия. Нейтрофилы повышены при следующих патологических состояниях:
- Любые (какие только могут быть) воспалительные процессы;
- Злокачественные заболевания (гематологические, солидные опухоли, метастазы в костный мозг);
- Метаболическая интоксикация (эклампсия при беременности, сахарный диабет);
- Оперативные вмешательства в первые сутки после операции (как реакция на травму), но высокие нейтрофилы на следующий день после хирургического лечения – нехороший признак (это говорит о том, что присоединилась инфекция);
- Трансфузии.
Следует заметить, что при некоторых заболеваниях отсутствие ожидаемого лейкоцитоза (или еще хуже – нейтрофилы понижены) относят к неблагоприятным «приметам», например, нормальный уровень гранулоцитов при острой пневмонии не дает обнадеживающих перспектив.
От рождения до зрелости
Свой жизненный цикл нейтрофилы начинают в костном мозге от миелобласта и, проходя стадии промиелоцита, миелоцита, метамиелоцита (юные) доходят до клетки, способной покинуть место рождения. В анализе крови они представлены созревающими формами – палочкоядерными лейкоцитами (предпоследняя, 5 стадия развития нейтрофила до сегментоядерной клетки, поэтому их так мало по сравнению с сегментами) и зрелыми сегментоядерными нейтрофилами.
Название «палочки» и «сегменты» нейтрофильные гранулоциты получили из-за формы ядра: у палочек оно напоминает жгут, а у сегментов разделено на дольки (от 2 до 5 сегментов). Покинув костный мозг в качестве зрелой клетки, нейтрофильные гранулоциты разделяются на 2 части: одна отправляется «в свободное плавание», чтобы постоянно наблюдать «что да как», другая уходит в запас – прикрепляется к эндотелию и ждет своего часа (пристеночное стояние – готовность к выходу из сосуда). Нейтрофилы, как и другие клетки лейкоцитарного звена, выполняют свои функции за пределами сосудов, а кровеносное русло используют лишь как дорогу в очаг воспаления, но если нужно, резервный пул отреагирует очень быстро и сразу включится в процесс защиты.
Однако может создаваться такая ситуация, когда истрачены все запасы, костный мозг работает, но не успевает обеспечить потребности в лейкоцитах, тогда в кровь начинают выходить молодые формы (юные) и даже миелоциты, которых в норме, как сказано выше, там никак быть не должно. Иногда эти незрелые клетки, пытаясь поправить положение, выходят из костного мозга в больших количествах, поэтому при серьезных патологических процессах так заметно меняется лейкоцитарная формула крови. Следует отметить, что незрелые клетки, покинувшие костный мозг, не в полной мере приобрели способности зрелых полноценных сегментоядерных нейтрофилов. Фагоцитарная активность метамиелоцитов еще достаточно высокая (до 67%), у миелоцитов она уже не доходит до 50%, а у промиелоцитов активность фагоцитоза и вовсе низкая – 10%.
Нейтрофилы двигаются, подобно амебам, а за счет этого они, перемещаясь вдоль капиллярных стенок, не только циркулируют в кровеносном русле, но и (при необходимости) покидают кровоток, направляясь в места воспаления.
Нейтрофилы – активные микрофаги, в их компетенцию, в основном, входит захват возбудителей острых инфекций, в то время как макрофаги, к которым относятся моноциты и неподвижные гистиоциты, заняты в фагоцитозе возбудителей хронических инфекций и продуктов клеточного распада. Зернистость в цитоплазме (наличие гранул) относит нейтрофилы к гранулоцитам и в эту группу, помимо них, входят базофилы и эозинофилы.
Кроме основной функции – фагоцитоза, где нейтрофилы выступают в качестве убийц, эти клетки в организме имеют и другие задачи: выполняют цитотоксическую функцию, участвуют в процессе свертывания (способствуют образованию фибрина), помогают формированию иммунного ответа на всех уровнях иммунитета (имеют рецепторы к иммуноглобулинам Е и G, к лейкоцитарным антигенам классов А, В, С системы HLA, к интерлейкину, гистамину, компонентам системы комплемента).
После двух перекрестов нормы уравниваются
Лейкоцитарная формула детей (особенно маленьких) заметно отличается от таковой у взрослых. Все это объясняется изменением соотношения лимфоцитов и нейтрофилов от рождения и до 14-15-летнего возраста.
Многие слышали, что у детей бывают некие перекресты (если начертить график) и вот, что все это значит:
- У новорожденного ребенка, который только появился на свет, количество нейтрофильных гранулоцитов находится где-то в пределах 50-72%, а лимфоцитов – около 15-34%, однако число нейтрофилов в первые часы жизни продолжает нарастать. Затем (не проходит и суток) популяция нейтрофильных лейкоцитов резко меняет направление в обратную сторону и начинает снижаться, лимфоциты, при этом, двигаются ей навстречу, то есть, повышаются. В какой-то момент, обычно это происходит между 3 и 5 днем жизни, числа этих клеток уравниваются, и кривые на графике пересекаются – это и есть первый перекрест. После перекреста лимфоциты еще некоторое время будут повышаться, а нейтрофилы снижаться (приблизительно до конца второй недели жизни), чтобы опять повернуть в обратную сторону.
- Через полмесяца ситуация опять меняется: уровень лимфоцитов снижается, содержание нейтрофилов растет, только этот процесс идет уже не в столь быстром темпе. Точки пересечения эти клетки достигнут, когда ребенок будет собираться в первый класс – это время второго перекреста.